Quantità
Totale
Prodotto aggiunto al carrello
Ci sono 0 prodotti nel carrello. Ci sono 0 prodotti nel carrello.
Totale prodotti
Totale consegna (iva incl.) To be determined
Totale
Continua acquisti Procedi con l'ordine
ARCHIVIO NEWS
CATEGORIE NEWS

Molti sono i motivi che ci hanno portato, ormai da alcuni anni, a convertire moltissimi prodotti a base solvente in base acquosa: dalla salubrità degli ambienti di lavoro alla sicurezza e salute per gli operatori, dalla riduzione delle emissioni nocive alla loro sostenibilità. Dagli addetti del settore viene ancora, però, una critica a questo tipo di conversione: "le performance dei prodotti a base solvente sono superiori a quelle dei cugini a base acqua". Questo é stato vero per molto tempo, ma negli ultimi anni lo sviluppo di nuove emulsioni con gruppi funzionali sempre più sofisticati e l'ausilio di additivi altamente performanti hanno permesso di formulare prodotti ad acqua con caratteristiche qualitative uguali, e in molti casi anche superiori, ai prodotti a solvente.
Per comprendere meglio quali risorse hanno i prodotti a base acquosa ecco le principali caratteristiche e comportamenti di questa preziosa sostanza:
Nonostante l’acqua sia la sostanza più presente in natura e pertanto considerata ordinaria, essa presenta caratteristiche straordinarie in parte ancora da sfruttare. Le sue particolari proprietà chimico-fisiche danno luogo a una serie fenomeni particolari che possiamo riscontrare quotidianamente come l’ebollizione, l’alto calore specifico, la capillarità, l'elevato potere solvente e la tensione superficiale.
E' noto che la molecola dell’acqua è formata da un atomo di ossigeno e due di idrogeno che formano una sorta di V, con l'atomo di ossigeno, più grande, al vertice e i due atomi di idrogeno, più piccoli, alle estremità opposte, formando un angolo di 104,45°.
Nella molecola dell'acqua gli atomi sono tenuti insieme da un legame di tipo covalente che prevede la messa in comune degli elettroni presenti negli orbitali periferici. All’esterno la molecola d’acqua si presenta come un dipolo, infatti nonostante sia elettricamente neutra, la forma a V dà origine a due polarità: la carica “+” tra i due atomi di idrogeno e la carica “-“ dell’ossigeno.

Queste due aree con carica opposta generano una configurazione dipolare che attrae le varie molecole d’acqua in un’interazione chiamata appunto “dipolo-dipolo”.
Esiste un'altra forza che attrae tra loro le molecole d’acqua, più intensa di quella dei dipoli, ma minore del legame covalente: si tratta del cosiddetto legame idrogeno a cui vanno attribuite le eccezionali proprietà fisiche dell’acqua. Questo legame è dovuto alla presenza degli atomi di idrogeno che tendono a legarsi con gli atomi di ossigeno delle molecole vicine con un’intensità esaltata dall’elevata elettronegatività dell’ossigeno e dalla parziale carica positiva che favorisce il legame intermolecolare. Il legame idrogeno genera un’attrazione tra le molecole d’acqua di una intensità che non ha eguali negli altri liquidi. Le molecole d’acqua possono formare quattro legami idrogeno con le loro vicine creando una struttura tetraedrica le cui facce sono triangoli equilateri. Questa configurazione si ripete in tutto il liquido fino a formare una sorta di reticolo tridimensionale mobile e elastico, con legami che si formano e si rompono di continuo. L’acqua non è quindi un semplice insieme di molecole tra loro dissociate, bensì una struttura legata che come tale si comporta anche a livello macroscopico.
Vista questa particolare struttura molecolare è possibile comprendere meglio la natura e le straordinarie caratteristiche dell’acqua e dei suoi comportamenti visibili nella vita di tutti i giorni da sembrare normali.
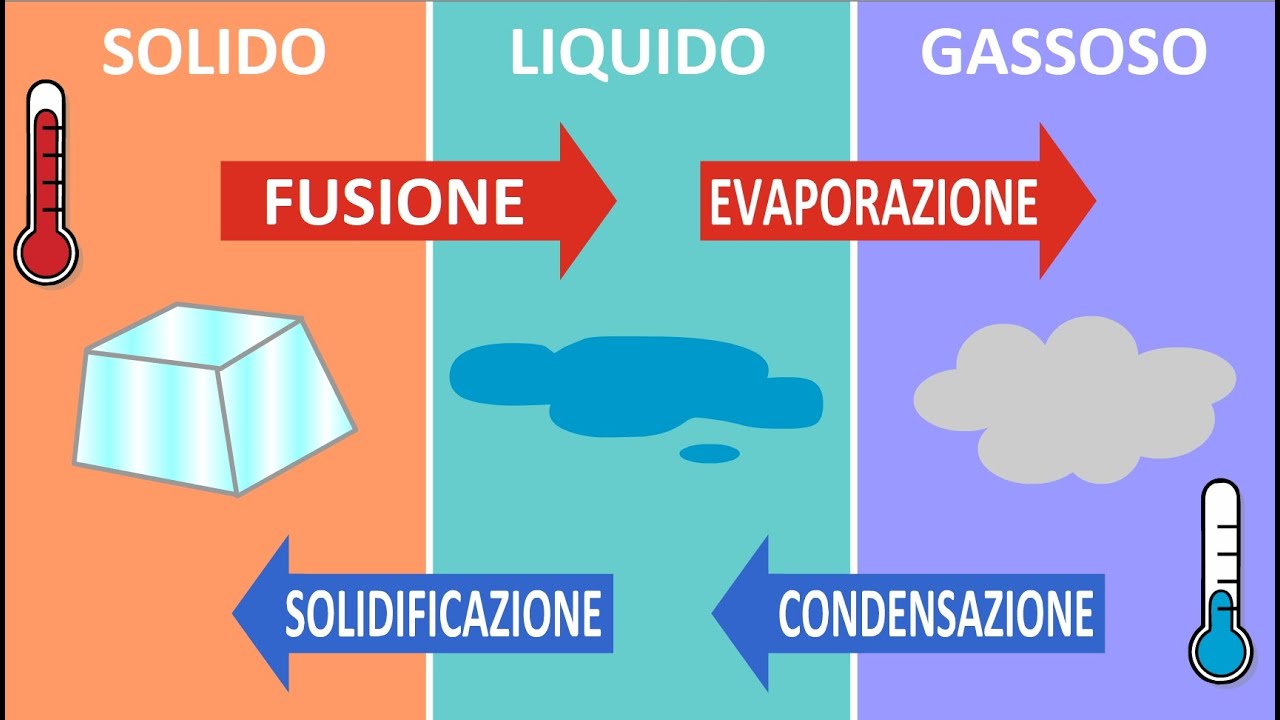
La temperatura di ebollizione (e quella di fusione) dell’acqua è molto più alta rispetto a quella di altre molecole simili che si trovano infatti lo stato gassoso: l'acido solfidrico (H2S) è un gas, così come lo sono il metano (CH4), l’ammoniaca (NH3) e l’acido cloridrico (HCl), tutte molecole di dimensioni paragonabili a quella dell’acqua e con la presenza di atomi di idrogeno. A temperatura ambiente, quindi, l’acqua dovrebbe presentarsi allo stato gassoso e non liquido; tuttavia, grazie proprio ai forti legami idrogeno, l’acqua presenta un punto di ebollizione molto più alto rispetto a quello delle sostanze molecolarmente simili. Per esempio l’acido solfidrico è una molecola con struttura affine a quella dell’acqua, ma lo zolfo è meno elettronegativo dell’ossigeno così i legami idrogeno che si generano sono debolissimi, quasi inesistenti.
Il fluoro invece è più elettronegativo dell’ossigeno, ma la molecola di acido fluoridrico (HF) ha un solo atomo di idrogeno e può quindi creare un solo legame con le molecole circostanti (anziché i quattro dell’acqua).
Di seguito una tabella con le temperature di ebollizione e fusione di alcune molecole simili all’acqua:
| Sostanza | Formula molecolare | Temperatura di ebollizione (°C) | Temperatura di fusione (°C) |
|---|---|---|---|
| ACQUA | H2O | +100 | 0 |
| Acido fluoridrico | HF | +19,5 | -83,55 |
| Ammoniaca | NH3 | -33,34 | -77,73 |
| Acido solfidrico | H2S | -60 | -82 |
| Acido cloridrico | HCl | -85,05 | -114,22 |
| Metano | CH4 | -161,5 | -182 |
La capillarità è un fenomeno dovuto all’effetto combinato di forze di adesione e coesione grazie al quale l’acqua può risalire le pareti di uno stretto recipiente, violando il principio dei vasi comunicanti. Grazie alla capillarità l’acqua può raggiungere la cima degli alberi più alti o imbibire velocemente una struttura porosa come una spugna, un fazzoletto di carta, un mattone, ecc. Con l’adesione le molecole dell’acqua stabiliscono un contatto con le molecole della parete del recipiente e grazie al legame idrogeno queste molecole riescono ad “arrampicarsi” lungo le pareti, mentre la forte coesione consente alla massa d’acqua di rimanere unita salendo. Questo fenomeno è tanto più evidente quanto più piccolo è il capillare.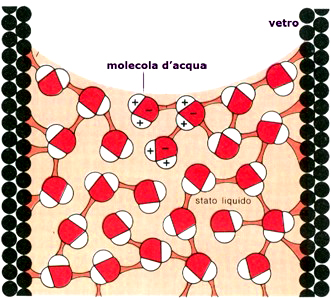
L’acqua ha un elevato calore specifico: questo significa che occorre molta energia per innalzarne la temperatura (4,184 J/g °C), una quantità superiore rispetto a quella richiesta da molte altre sostanze. Questa proprietà dipende ancora dai legami a idrogeno: l’agitazione termica delle molecole viene contrastata dalle forze di attrazione e una delle principali conseguenze di questo fatto è il volano termico, ovvero l’effetto calmierante sul clima dovuto alle grandi masse d’acqua.
Un altro comportamento anomalo dell’acqua è dato dall’aumento del volume di congelamento della massa liquida. A livello domestico sono ben note le conseguenze di questo fenomeno: quando la temperatura va sottozero le tubazioni piene d’acqua si rompono, in una bottiglia piena messa nel freezer salta il tappo. Nell’acqua liquida agiscono due forze opposte, i legami a idrogeno da una parte tendono ad organizzare il reticolo di tetraedri mentre il movimento caotico delle molecole ne impedisce la perfetta formazione. Quando l’acqua congela i tetraedri sono obbligati a formarsi e la struttura complessiva assume la configurazione più aperta e meno densa. Questo è il motivo per cui, stranamente, il ghiaccio galleggia.
Il potere solvente di una sostanza è la capacità che la stessa ha di scioglierne un’altra fino a formare una soluzione. L’acqua è un ottimo solvente avendo la capacità di spezzare i legami che tengono unite molte sostanze. Pensiamo al cloruro di sodio, cioè il sale da cucina, che si scioglie rapidamente in acqua perché le molecole polari dell’acqua attraggono gli ioni di carica opposta sino a spezzare il legame ionico del cristallo. Un analogo fenomeno avviene nel processo di mineralizzazione, cioè quando l’acqua, passando attraverso le rocce, ne discioglie una parte arricchendosi di sali minerali.
La tensione superficiale è la densità superficiale di energia di legame sull’interfaccia tra un corpo continuo e un materiale di un’altra natura, un solido, un liquido o un gas. L’acqua ha un’elevata tensione superficiale perché tra le molecole è presente una forte coesione (dovuta ai legami idrogeno), che tende a tenerle unite.
Grazie a questo fenomeno molti insetti riescono a camminare sull’acqua, visto che la loro massa non è sufficiente a rompere i legami tra le molecole d’acqua presenti superficie. Non basta il principio di galleggiamento di Archimede per spiegare il galleggiamento di una graffetta metallica o di una piccola monetina.
Ed è sempre grazie alla coesione che genera una forte tensione superficiale se le goccioline d’acqua assumono una forma sferica e se un bicchiere si può riempire per qualche millimetro oltre il bordo, senza traboccare.
Queste sono alcune delle più evidenti stranezze dell’acqua, un liquido straordinario che usiamo dall’origine dei tempi ma che abbiamo iniziato a conoscere solo di recente.
A queste vanno aggiunte quelle che sono in fase di studio, come ad esempio quello dei ricercatori americani del Rensselaer Polytechnic Institute secondo cui i suoni naturali, tra cui quello dell’acqua, rappresentano il sottofondo ideale per ottenere riposo, benessere psico-fisico, maggiore concentrazione e produttività.
